Aude Panatier dans Cell Metabolism
Alzheimer : un acide aminé pour aider à restaurer la mémoire ?
Source : Communique de presse national
Des scientifiques du Laboratoire des maladies neurodégénératives (CNRS / CEA / Université Paris-Saclay) et du Neurocentre Magendie (Inserm / Bodeaux Neurocampus – Université de Bordeaux) viennent de mettre en évidence le rôle déterminant que joue une voie métabolique dans les troubles de mémoire de la maladie d’Alzheimer. Leurs travaux, à paraître le 3 mars 2020 dans Cell Metabolism, montrent également qu’un apport en acide aminé particulier, sous forme de complément alimentaire, restaure la mémoire spatiale atteinte de façon précoce chez des souris modèles de la maladie. Une piste prometteuse pour atténuer la perte de mémoire liée à Alzheimer.
Le cerveau consomme une grande partie de l’énergie disponible dans notre organisme. Son bon fonctionnement repose sur une étroite coopération entre les neurones et les cellules de leur environnement, en particulier les astrocytes. La phase précoce de la maladie d’Alzheimer est caractérisée par une réduction de ce métabolisme énergétique, mais on ignorait si ce déficit pouvait contribuer directement aux symptômes cognitifs de la maladie d’Alzheimer.
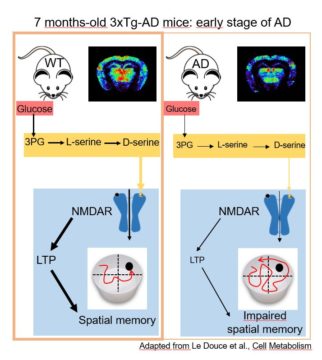
Une étude collaborative a montré chez une souris modèle de la maladie d’Alzheimer que la diminution de la consommation de glucose par les astrocytes conduit à une réduction de la production de L-sérine, un acide aminé majoritairement produit par ces cellules dans le cerveau et dont la voie de biosynthèse est altérée chez les patients. La L-sérine est le précurseur de la D-sérine, connue pour stimuler les récepteurs NMDA, essentiels au bon fonctionnement du cerveau et à l’établissement de la mémoire. Dès lors, en produisant moins de L-sérine, les astrocytes sont à l’origine d’une diminution de l’activité de ces récepteurs, ce qui entraîne une altération de la plasticité neuronale et des capacités de mémorisation associées. Les scientifiques ont également démontré que les fonctions de mémorisation des souris ont toutes été restaurées par un apport alimentaire en L-sérine.
L’identification du rôle de la L-sérine dans les troubles de la mémoire et l’efficacité expérimentale d’une supplémentation nutritionnelle ouvrent la voie à de nouvelles stratégies, complémentaires des thérapies médicamenteuses, pour lutter contre les symptômes précoces de la maladie d’Alzheimer et d’autres maladies présentant des altérations du métabolisme cérébral, comme les maladies de Parkinson ou de Huntington. La L-sérine étant disponible comme complément alimentaire, il convient de tester de façon rigoureuse cette molécule chez l’humain, à travers des essais cliniques encadrés.
Ces travaux ont été menés par des chercheurs du Laboratoire des maladies neurodégénératives (CNRS/CEA/Université Paris-Saclay), au sein du MIRCen/Institut de biologie François Jacob, et du Neurocentre Magendie (Inserm / Bordeaux Neurocampus – Université de Bordeaux) en collaboration avec des équipes du laboratoire Neurosciences Paris Seine (CNRS/Inserm/Sorbonne Université), de l’Institut Galien Paris Sud (CNRS/Université Paris Saclay), du Centre de recherche en neurosciences de Lyon (CNRS/Inserm/Université Claude Bernard Lyon 1/Université Jean Monnet), du Département médicaments et technologies pour la santé (CEA/Inrae/Université Paris Saclay) et par des chercheurs de l’AP-HP au sein de l’hôpital de la Pitié-Salpétrière). Ces travaux ont été soutenus par l’association France Alzheimer, la Fondation de France, la Fondation pour la recherche médicale, la Fondation Alzheimer et l’Infrastructure nationale de biologie-Santé NeurATRIS
Comment in english
 Proper brain functioning relies on the close metabolic and synaptic interplay between neurons and astrocytes. Interestingly, the early stage of Alzheimer’s disease is associated with a decrease in brain metabolism and deficits in synaptic functions that are believed to underlie cognitive decline. However, whether there is a causal link between these processes remained unknown.
Proper brain functioning relies on the close metabolic and synaptic interplay between neurons and astrocytes. Interestingly, the early stage of Alzheimer’s disease is associated with a decrease in brain metabolism and deficits in synaptic functions that are believed to underlie cognitive decline. However, whether there is a causal link between these processes remained unknown.
The consumption of glucose by astrocytes leads to the production of various metabolites including L-serine, a precursor of D-serine, the endogenous co-agonist of synaptic NMDA receptor that is essential for long-term synaptic plasticity and memory. Thanks to a collaboration with the group of Gilles Bonvento (CNRS-CEA-University of Paris-Saclay) Aude Panatier and Stéphane Oliet (Neurocentre Magendie) show in a mouse model of Alzheimer’s disease that a decrease in glucose consumption by astrocytes leads to a reduction in the production of L-serine and, consequently, in D-serine supply. As a result, synaptic NMDA receptors activity is decreased, thereby impairing neuronal plasticity and memory. Importantly, such early cognitive deficits can be fully rescued by L-serine food supplementation.
The identification of the major role played by a glucose metabolite, L-serine, at an early stage of Alzheimer’s disease and the success of a nutritional supplementation opens the way to new therapeutic strategies in this neurodegenerative pathology.


Bibliographie
Impairment of Glycolysis-Derived L-Serine Production in Astrocytes Contributes to Cognitive Deficits in Alzheimer’s Disease. Juliette Le Douce*, Marianne Maugard*, Julien Veran*, Marco Matos*, Pierrick Jégo+, Pierre-Antoine Vigneron+, Emilie Faivre+, Xavier Toussay,Michel Vandenberghe, Yaël Balbastre, Juliette Piquet, Elvire Guiot, Nguyet Thuy Tran, Myriam Taverna, Stéphane Marinesco, Ayumi Koyanagi, Shigeki Furuya, Mylène Gaudin-Guerif, Sébastien Goutal, Aurélie Ghettas, Alain Pruvost, Alexis-Pierre Bemelmans, Marie-Claude Gaillard, Karine Cambon, Lev Stimmer, Véronique Sazdovitch, Charles Duyckaerts, Graham Knott, Anne-Sophie Hérard, Thierry Delzescaux, Philippe Hantraye, Emmanuel Brouillet, Bruno Cauli, Stéphane H.R. Oliet, Aude Panatier# et Gilles Bonvento#. Cell Metabolism, le 3 mars 2020.
*co-first autors
+equal contribution
#These authors jointly supervised this work
DOI : 10.1016/j.cmet.2020.02.004
Contact
Aude Panatier
T +33 5 57 57 37 30 (à partir du 9 mars)
Télécharger le communiqué de presse
Mise à jour: 31/03/20
