P. Opazo, D. Choquet et al. dans Cell Reports

CaMKII metaplasticity drives Aβoligomers-mediated synaptotoxicity. P. Opazo, S. Viana da Silva, M.Carta, C. Breillat, S. J. Coultrap, D. Grillo-Bosch, M. Sainlos, F. Coussen, K. U. Bayer, C. Mulle, D. Choquet. Cell Reports, le 12 juin 2018.
Institute for Interdisciplinary Neuroscience (IINS) / team : Dynamic organization & Function of synapses / Bordeaux University
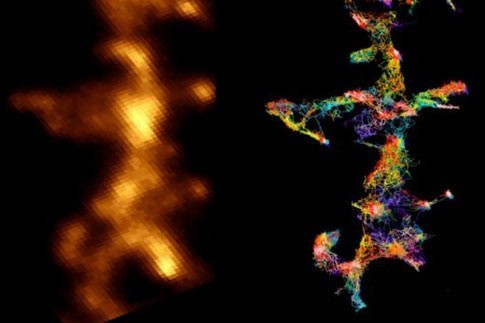
L’accumulation de peptides amyloïdes sous forme de plaques dans le cerveau est l’un des principaux marqueurs de la maladie d’Alzheimer. Si les effets délétères des agrégats de peptide amyloïdes sont établis, leur mécanisme d’action dans les cellules cérébrales restait mal défini. Des chercheurs du CNRS et de l’université de Bordeaux viennent de mettre en évidence qu’ils altèrent le fonctionnement normal des connections entre neurones en interagissant avec une enzyme clé de la plasticité synaptique. Publiés le 12 juin 2018 dans la revue Cell Reports.
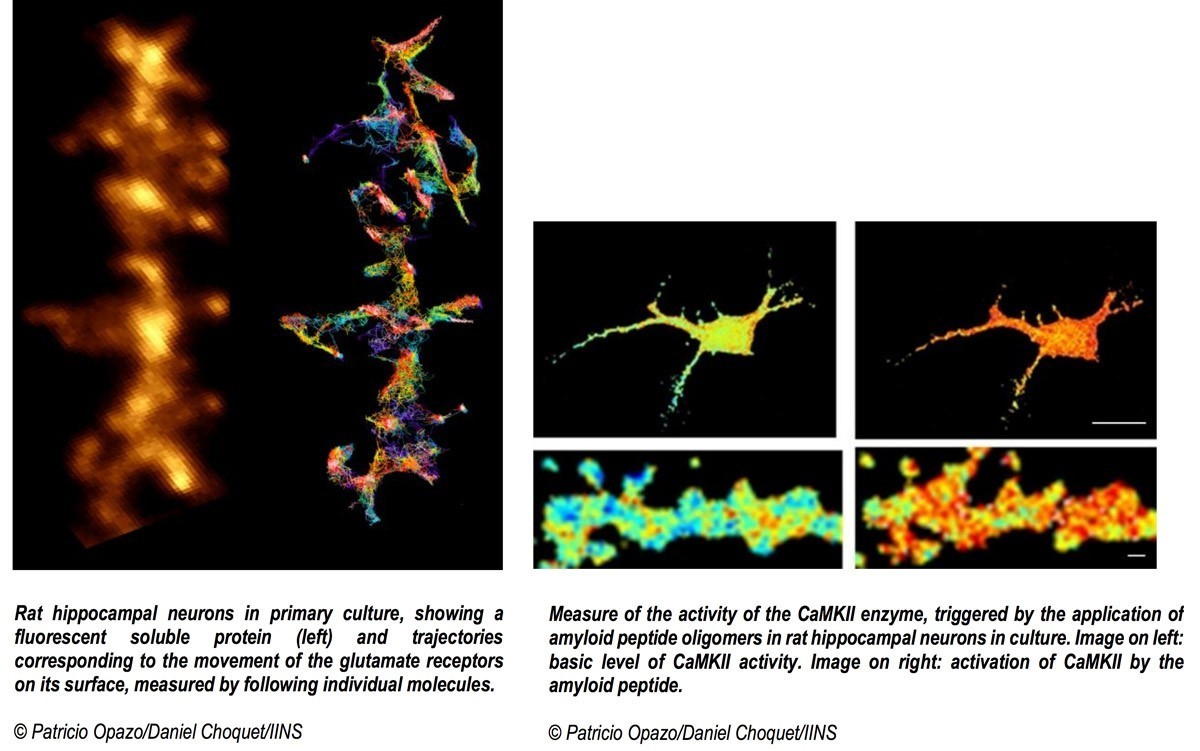
Touchant près d’un million de Français, la maladie d’Alzheimer est caractérisée par une altération précoce des facultés cognitives des patients suivie d’une dégénérescence neuronale dans les stades plus tardifs. Trois types de lésions cérébrales caractérisent la maladie : la perte neuronale, la dégénérescence fibrillaire et l’accumulation de peptides amyloïdes qui forment les plaques amyloïdes. L’implication respective de ces différents éléments dans le développement des symptômes de la maladie reste à ce jour mal connu. Les chercheurs savaient par exemple que le peptide amyloïde perturbe les synapses, les zones de contact et de communication chimique entre neurones, mais ignoraient comment, jusqu’aux travaux menés par les équipes de l’Institut interdisciplinaire de neurosciences (CNRS/université de Bordeaux). Celles-ci ont découvert le mécanisme moléculaire liant les agrégats amyloïdes aux déficits de fonctionnement des synapses observés dans des modèles animaux de la maladie d’Alzheimer : ces dépôts de peptides interagissent avec une enzyme clé de l’équilibre synaptique, ce qui empêche sa mobilisation normale.
Cette molécule, appelée CamKII, orchestre habituellement la plasticité synaptique, un phénomène d’adaptabilité des neurones leur permettant de renforcer la réponse aux signaux qu’ils échangent. Les ensembles de neurones qui codent pour une information à mémoriser sont connectés par des synapses, qui sont elles-mêmes sous contrôle de mécanismes de plasticité synaptique. Quand la connexion entre deux neurones doit être renforcée pour mémoriser une information, par exemple lors d’une stimulation intense, CamKII s’active et entraîne une cascade de réactions renforçant les capacités de transmission des messages entre ces neurones. La plasticité synaptique est au cœur de la mémoire et de l’apprentissage. Les peptides amyloïdes empêchent CamKII de participer au processus de plasticité synaptique et ce blocage entraîne à terme la disparition de la synapse. Cette découverte pourrait trouver son application dans les phases précoces de la maladie d’Alzheimer où sont observées les premiers déficits cognitifs, qui pourraient être liés à un tel dysfonctionnement des synapses.
L’objectif maintenant pour les chercheurs est de poursuivre l’étude de l’effet des agrégats amyloïdes en essayant en particulier d’empêcher leur interaction avec CamKII et la perte des synapses observées au cours de la maladie.
Mise à jour: 11/07/18
