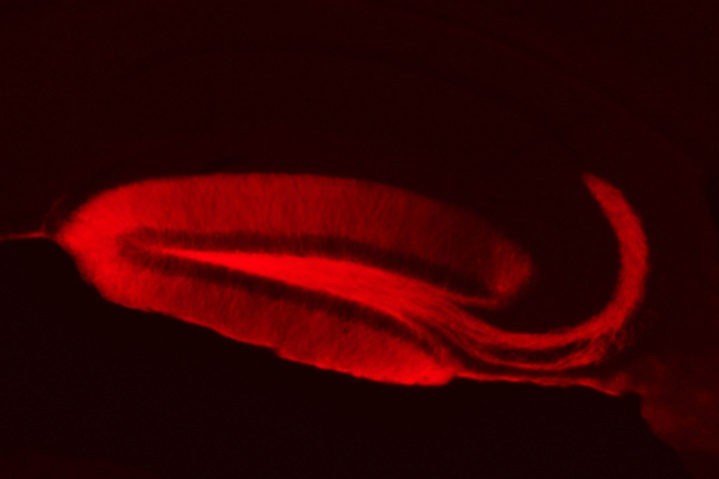
G. Barthet, C. Mulle et al. dans Nature comm.
Maladie d’Alzheimer : la préséniline contrôle la plasticité des connections du cerveau.
Nat Commun. 2018 Nov 14;9(1):4780. doi: 10.1038/s41467-018-06813-x.
Presenilin-mediated cleavage of APP regulates synaptotagmin-7 and presynaptic plasticity. , Gael Barthet, Jordà-Siquier T, Rumi-Masante J, Bernadou F, Müller U, Mulle C
Equipe IINS Christophe Mulle : « Synaptic Circuits of Memory »
Interdisciplinary Institute for Neuroscience, CNRS UMR 5297, Bordeaux, University of Bordeaux
Institute for Pharmacy and Molecular Biotechnology, Im Neuenheimer Feld 364, Heidelberg, 69120, Germany.
 Les mutations génétiques de la préséniline (PS) provoquent une forme précoce de la maladie d’Alzheimer. Le rôle physiologique de la PS reste un mystère, en particulier dans les synapses, les zones de contact qui permettent le transfert d’information d’un neurone à l’autre. Ce travail montre que la PS, très abondante dans les synapses, contrôle la machinerie de libération du messager chimique. Un dysfonctionnement présynaptique peut donc être un facteur de dérégulation des circuits neuronaux dans la maladie d’Alzheimer.
Les mutations génétiques de la préséniline (PS) provoquent une forme précoce de la maladie d’Alzheimer. Le rôle physiologique de la PS reste un mystère, en particulier dans les synapses, les zones de contact qui permettent le transfert d’information d’un neurone à l’autre. Ce travail montre que la PS, très abondante dans les synapses, contrôle la machinerie de libération du messager chimique. Un dysfonctionnement présynaptique peut donc être un facteur de dérégulation des circuits neuronaux dans la maladie d’Alzheimer.
Les mutations des gènes codant la préséniline (PS) ou la protéine précurseur amyloïde (APP), provoquent une forme précoce de la maladie d’Alzheimer. Ces protéines sont très abondantes dans les synapses, les zones de contact qui permettent le transfert d’information d’un neurone à l’autre dans le cerveau. Du côté « présynaptique » des synapses, la libération de messagers chimiques, les neurotransmetteurs, est contrôlée par une machinerie complexe comprenant un grand nombre de protéines. La libération de neurotransmetteurs est variable et dynamique, on parle de plasticité présynaptique. C’est un élément essentiel du bon fonctionnement des circuits neuronaux et un des mécanismes clefs de la mémoire. Un dysfonctionnement de la plasticité synaptique est souvent synonyme de déficit cognitif.
La PS et l’APP sont des protéines abondantes des compartiments présynaptiques, mais leur rôle physiologique y reste un mystère. Partant de l’hypothèse que la PS joue un rôle dans la plasticité présynaptique, les chercheurs ont développé des outils de transfert de gène chez la souris pour combiner la manipulation de gènes « présynaptiques » et la stimulation par une lumière bleue, sélective des synapses mutées (techniques d’optogénétiques combinées à l’électrophysiologie).
L’invalidation sélective de la PS dans un circuit synaptique impliqué dans la mémoire provoque un déficit majeur de plasticité présynaptique à court terme empêchant le transfert d’information entre ces neurones.
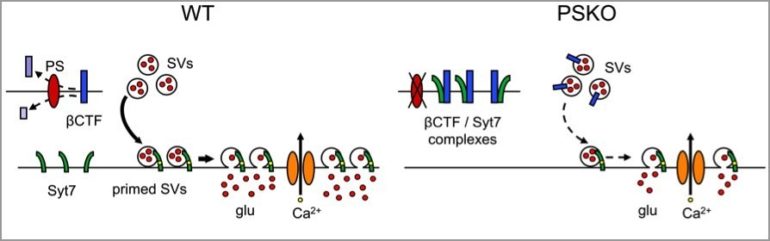
Les chercheurs ont découvert que la délétion génétique de la PS induit une perte quasi-complète de l’expression d’une protéine présynaptique essentielle à la plasticité synaptique, la synaptotagmine 7. Cette régulation dépend de l’activité enzymatique de la PS, qui découpe certaines protéines membranaires, dont l’APP, en plus petits fragments. Lorsque l’activité de la PS est perturbée, il y a une accumulation de fragments non découpés d’APP dans la membrane présynaptique, ce qui induit une déstabilisation de la synaptotagmine 7 et une perte de facilitation présynaptique.
Ce nouveau rôle de la PS souligne que l’altération des processus présynaptiques doit être prise en compte dans les mécanismes physiopathologiques de la maladie d’Alzheimer.
1er auteur
 Gaël Barthet – Post doc depuis 2012 dans l’équipe de Christophe Mulle: « Synaptic Circuits of Memory »
Gaël Barthet – Post doc depuis 2012 dans l’équipe de Christophe Mulle: « Synaptic Circuits of Memory »
Short bio: 2007 PhD in Neurosciences on the molecular and cellular mechanisms of serotonergic drugs.. Institute of Functional Genomic – Montpellier.
1er post-doc ( 2008-2011 ; fonctions cellulaires de la préséniline; Alzheimer) à l’hôpital Mount Sinai de New York dans le laboratoire de Nikos Robakis.
Gaël Barthet est un biologiste cellulaire et électrophysiologiste travaillant sur la maladie d’Alzheimer. Depuis 2012, il travaille au sein du groupe de Christophe Mulle à l’Institut Interdisciplinaire des NeuroSciences de Bordeaux où il développe des outils optogénétiques et les associe à l’électrophysiologie, à l’imagerie et à la biochimie pour identifier le rôle de la préséniline et de l’APP dans les mécanismes présynaptiques.
Mise à jour: 26/06/20
