E. Soria Gomez, G. Marsicano et L. Bellochio dans Neuron
Le cannabis est l’une des drogues les plus utilisées dans le monde. Par conséquent, le Δ9-tetrahydrocannabinol (THC), son principal composé psychoactif, est la troisième substance addictogène dont l’usage récréatif est le plus populaire après l’éthanol et la nicotine. Plusieurs états américains, comme d’autres pays dans le monde, ont légalisé l’usage récréatif du cannabis. Outre cet usage, le cannabis est également utilisé en médecine depuis des millénaires, notamment dans la gestion de la douleur. Cependant, sa consommation est associée à plusieurs effets indésirables, voire dangereux, dont l’altération de la coordination motrice et la catalepsie (abolition du mouvement volontaire des muscles). Ces derniers effets, souvent observés avec des drogues antipsychotiques de première génération qui agissent sur le système des ganglions de la base, sont la cause majeure des accidents de voiture sous l’effet du cannabis.
Les ganglions de la base sont un groupe de noyaux cérébraux essentiels pour contrôler et coordonner l’activité motrice, le striatum en étant le noyau central. De manière intéressante, les neurones de ce dernier présentent les plus forts niveaux d’expression des récepteurs aux cannabinoïdes de type 1 (CB1) au niveau cérébral. Ces neurones peuvent être divisés en 2 populations formant les voies striatales (i) directe et (ii) indirecte, discriminés par leur région cible, respectivement le Globus Pallidus externe et la Substance Noire réticulée. Ce dernier circuit, dit striatonigral, constitue une cible potentielle expliquant les effets à la fois bénéfiques et délétères du THC de par son rôle crucial dans la régulation de la motricité et la nociception. Les récepteurs CB1 neuronaux sont principalement associés aux membranes plasmatiques des terminaisons axonales, où ils régulent la transmission synaptique. Cependant, de précédentes études de notre groupe et d’autres laboratoires montrent que les récepteurs CB1 sont également présents dans des compartiments intracellulaires, notamment associés aux mitochondries influençant la mémoire par contrôle des processus bioénergétiques. La présence de différentes populations de récepteurs CB1 au niveau subcellulaire suggère que leur activation par les cannabinoïdes pourrait mener à des effets distincts au sein d’un même circuit. En combinant des approches génétique et comportementale, notre travail montre que les récepteurs CB1 de la voie striatale directe sont responsables de l’action multimodale du THC, par leur distribution subcellulaire. Donc, en agissant sur des voix de signalisation différentes dans les mêmes neurones, on a été capable de dissocier l’effet analgésique de la catalepsie induite par une injection aigue de THC ou autres cannabinoïdes de synthèse. En savoir plus : voir abstract [EN] et figure ci-dessous.
Ces résultats sont cruciaux pour une meilleure compréhension des mécanismes d’action du cannabis et pour le développement de nouvelles stratégies thérapeutiques basées sur ses effets bénéfiques (e.g. analgésie) tout en évitant ses effets délétères (e.g. catalepsie).
Ce travail de recherche a été dirigé par Giovanni Marsicano et Luigi Bellocchio, dans l’équipe « Endocannabinoïdes et Neuroadaptation » au Neurocentre Magendie. Pour la réussite de ce travail les deux chercheurs ont collaboré avec l’équipe de Jérôme Baufreton, à l’institut des Maladies Neurodégénératives de Bordeaux et aussi à l’étranger avec l’Université de Bilbao en Espagne et l’Université de Calgary au Canada.
Abstract
Recent advances in neuroscience have positioned brain circuits as key units in controlling behavior, implying that their positive or negative modulation necessarily leads to specific behavioral outcomes. However, emerging evidence suggests that the activation or inhibition of specific brain circuits can actually produce multimodal behavioral outcomes.
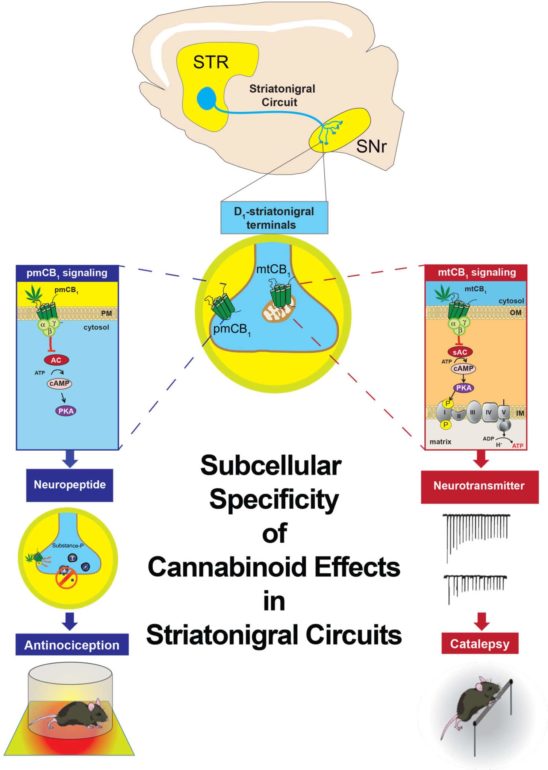 This study shows that activation of a receptor at different subcellular locations in the same neuronal circuit can determine distinct behaviors. Pharmacological activation of type 1 cannabinoid (CB1) receptors in the striatonigral circuit elicits both antinociception and catalepsy in mice. The decrease in nociception depends on the activation of plasma membrane-residing CB1 receptors (pmCB1), leading to the inhibition of cytosolic PKA activity and substance P release. By contrast, mitochondrial-associated CB1 receptors (mtCB1) located at the same terminals mediate cannabinoid-induced catalepsy through the decrease in intra-mitochondrial PKA-dependent cellular respiration and synaptic transmission. Thus, subcellular-specific CB1 receptor signaling within striatonigral circuits determines multimodal control of behavior.
This study shows that activation of a receptor at different subcellular locations in the same neuronal circuit can determine distinct behaviors. Pharmacological activation of type 1 cannabinoid (CB1) receptors in the striatonigral circuit elicits both antinociception and catalepsy in mice. The decrease in nociception depends on the activation of plasma membrane-residing CB1 receptors (pmCB1), leading to the inhibition of cytosolic PKA activity and substance P release. By contrast, mitochondrial-associated CB1 receptors (mtCB1) located at the same terminals mediate cannabinoid-induced catalepsy through the decrease in intra-mitochondrial PKA-dependent cellular respiration and synaptic transmission. Thus, subcellular-specific CB1 receptor signaling within striatonigral circuits determines multimodal control of behavior.
Référence
Subcellular specificity of cannabinoid effects in striatonigral circuits.
Soria-Gomez E, Pagano Zottola AC, Mariani Y, Desprez T, Barresi M, Bonilla-Del Río I, Muguruza C, Le Bon-Jego M, Julio-Kalajzić F, Flynn R, Terral G, Fernández-Moncada I, Robin LM, Oliveira da Cruz JF, Corinti S, Amer YO, Goncalves J, Varilh M, Cannich A, Redon B, Zhao Z, Lesté-Lasserre T, Vincent P, Tolentino-Cortes T, Busquets-García A, Puente N, Bains JS, Hebert-Chatelain E, Barreda-Gómez G, Chaouloff F, Lohman AW, Callado LF, Grandes P, Baufreton J, Marsicano G, Bellocchio L.
Neuron ; 25 mars 2021
https://doi.org/10.1016/j.neuron.2021.03.007
Contacts
Luigi Bellochio
Neurocentre Magendie
Giovanni Marsicano
Neurocentre Magendie
Mise à jour: 15/11/23
