
Vers une compréhension moléculaire du contrôle mécanique de la migration cellulaire
Les cellules génèrent les forces nécessaires à leur mouvement grâce au cytosquelette qui déforme leur enveloppe membranaire. Les scientifiques, dont plusieurs chercheurs de l’IINS, ont montré que les protéines initiatrices du cytosquelette sont contrôlées en retour par les forces associées à la formation du cytosquelette. Pour ce faire, ils ont utilisé des techniques de traçage de protéines individuelles et ont développé une stratégie originale pour sonder mécaniquement ces nanomachines intracellulaires. Ces travaux sont publiés dans la revue Nature Cell Biology.
Les mécanismes qui contrôlent la morphologie et la migration des cellules sont essentiels à la formation des organes, la réponse immunitaire ou la communication intercellulaire. En formant des protrusions membranaires qui adhérent et génèrent des forces sur la matrice extracellulaire et les cellules voisines, les cellules contrôlent leur environnement, leur forme et leur mouvement. Pour y parvenir, elles ont la capacité d’ajuster l’organisation moléculaire de leurs structures adhésives et de leur cytosquelette en réponse aux changements de la nature biochimique et physique de leur environnement.
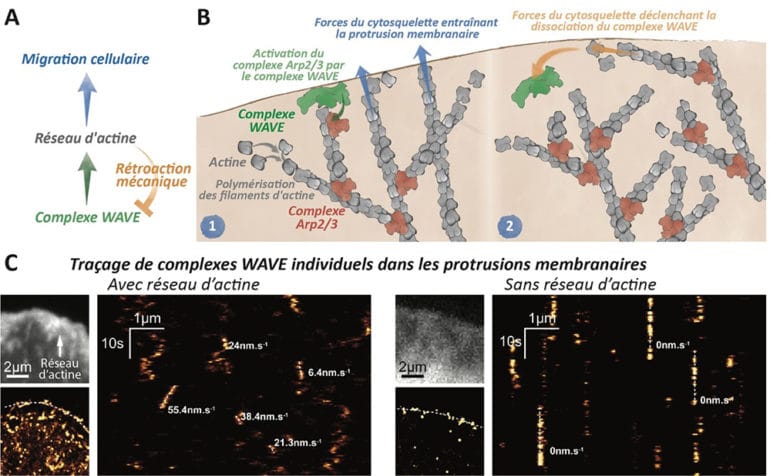
L’adaptation mécanique des structures adhésives a été démontrée il y a plusieurs décennies, et certains des mécanismes moléculaires impliqués sont maintenant relativement bien compris. Identifiée de façon plus récente, l’adaptation du cytosquelette aux forces mécaniques apparaît comme un processus clé pour réguler son assemblage, son architecture et sa stabilité mécanique. En revanche, les mécanismes moléculaires responsables de cette adaptation mécanique sont encore inconnus. Cette plasticité mécanique a été démontrée pour le cytosquelette d’actine, dont l’assemblage génère les forces responsables, par exemple, du transport intracellulaire et de la propagation intra- et intercellulaire d’agents pathogènes (bactéries, virus). L’assemblage de réseaux d’actine est également le moteur de la migration cellulaire car les forces mécaniques qui en résultent déforment la membrane cellulaire. La plasticité mécanique d’un réseau d’actine pourrait résulter d’une réorganisation de l’architecture globale de ce réseau soumis à une contrainte mécanique. Cependant, les forces locales générées lors de l’assemblage de polymères d’actine pourraient agir mécaniquement sur la fonction des protéines qui initient ces polymères.
Dans cette étude, les chercheurs ont démontré que les forces générées par l’assemblage des réseaux d’actine non seulement déforment la membrane, mais agissent aussi directement sur les protéines qui initient ces réseaux d’actine. Ils ont révélé que des forces locales (de l’ordre du piconewton) générées par les extrémités des filaments d’actine lors de leur assemblage au sein des protrusions membranaires agissent mécaniquement sur la dynamique et la fonction des protéines initiatrices de ces polymères, en particulier le complexe WAVE. Ce nouveau mécanisme de rétroaction mécanique permet un contrôle immédiat et local de l’assemblage des réseaux d’actine sur eux-mêmes, et contrôle ainsi la vitesse et la formation de protrusions membranaires. Cette étude constitue un premier pas vers une compréhension moléculaire du contrôle mécanique de la migration cellulaire.
Référence :
Forces generated by lamellipodial actin filament elongation regulate the WAVE complex during cell migration.
Amine Mehidi, Frieda Kage, Zeynep Karatas, Maureen Cercy, Matthias Schaks, Anna Polesskaya, Matthieu Sainlos, Alexis Gautreau, Olivier Rossier, Klemens Rottner and Grégory Giannone
Nature Cell Biology 4 November 2021. https://doi.org/10.1038/s41556-021-00786-8
Mise à jour: 09/11/21
