Florent Laferrière, Erwan Bezard, Francesca De Giorgi, François Ichas et al. dans npj Parkinson’s disease
Quand la composition des inclusions pathologiques révèle une origine neuronale des inclusions gliales d’alpha-synucléine de l’atrophie multi-systématisée.
Commentaire :
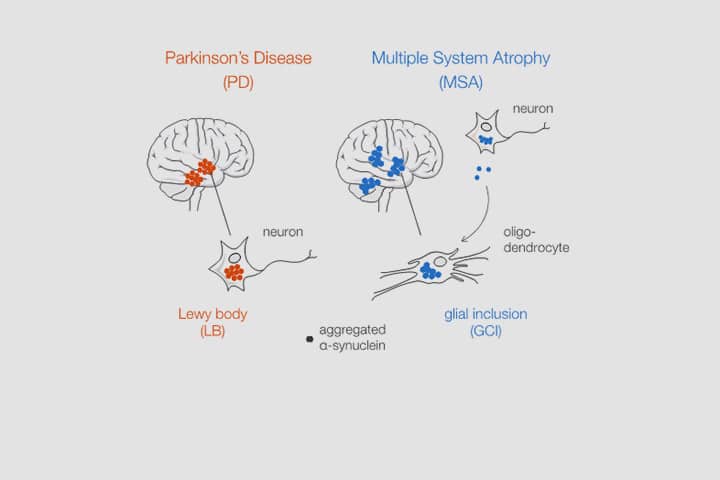
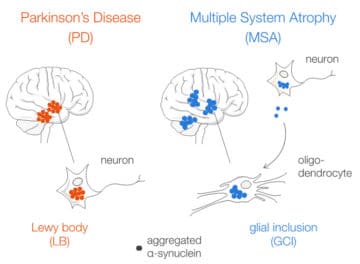
Les synucléinopathies, telles que la maladie de Parkinson (PD) ou l’atrophie-multi-systématisée (MSA) sont un groupe de maladies neurodégénératives de phénotypes extrêmement distincts qui partagent néanmoins des caractéristiques communes dont la plus importante est l’agrégation de l’alpha-synucléine (α-syn). Cette petite protéine présynaptique qui est impliquée dans la régulation de la fonction synaptique, est retrouvée au sein d’inclusions dans les neurones pour PD (les corps de Lewy, LB) et dans les oligodendrocytes pour la MSA (inclusions gliales cytoplasmiques, GCI). Néanmoins, l’origine, les mécanismes de formation, et le rôle physiopathologique de ces inclusions ne sont pas compris. Celles-ci pourraient résulter de la séquestration de l’α-syn agrégée par la cellule.
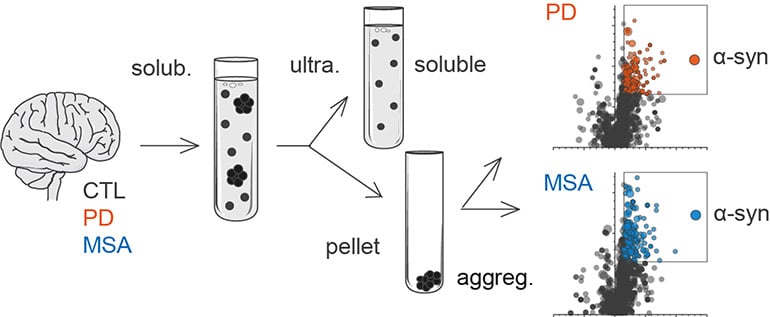
Dans un article publié dans npj Parkinson’s disease, Florent Laferrière et al. ont réalisé une analyse de protéomique comparée à des extraits insolubles issus d’échantillons de cerveaux de patients contrôles, PD et MSA. Les résultats de cette étude montrent que 1) l’α-syn est de loin la protéine la plus enrichie dans les extraits insolubles PD et MSA en comparaison aux contrôles ; 2) les protéomes insolubles des échantillons PD et MSA sont très similaires et sont composés en grande majorité de protéines mitochondriales et synaptiques ; et 3) aucune autre protéine à forte propension agrégative qui aurait pu co-agréger avec l’α-syn n’est retrouvée dans les extraits PD et MSA.
Ces résultats suggèrent que les GCI retrouvés dans les oligodendrocytes pour la MSA sont formés à partir d’agrégats pré-assemblés qui proviennent des neurones. D’autre part, aucune autre protéine amyloïde (tau, TDP-43) n’est retrouvée co-agrégée au sein des LB et GCI. Enfin, ces inclusions présentent une empreinte protéique indiquant la séquestration de composants mitochondriaux et synaptiques, qui sont autant de pistes dans la compréhension des raisons et mécanismes de leur formation.
Abstract
Aggregated alpha-synuclein (α-syn) is a principal constituent of Lewy bodies (LBs) and glial cytoplasmic inclusions (GCIs) observed respectively inside neurons in Parkinson’s disease (PD) and oligodendrocytes in multiple system atrophy (MSA). Yet, the cellular origin, the pathophysiological role, and the mechanism of formation of these inclusions bodies (IBs) remain to be elucidated. It has recently been proposed that α-syn IBs eventually cause the demise of the host cell by virtue of the cumulative sequestration of partner proteins and organelles. In particular, the hypothesis of a local cross-seeding of other fibrillization-prone proteins like tau or TDP-43 has also been put forward. We submitted sarkosyl-insoluble extracts of post-mortem brain tissue from PD, MSA and control subjects to a comparative proteomic analysis to address these points. Our studies indicate that: i) α-syn is by far the most enriched protein in PD and MSA extracts compared to controls; ii) PD and MSA extracts share a striking overlap of their sarkosyl-insoluble proteomes, consisting of a vast majority of mitochondrial and neuronal synaptic proteins, and (iii) other fibrillization-prone protein candidates possibly cross-seeded by α-syn are neither found in PD nor MSA extracts. Thus, our results (i) support the idea that pre-assembled building blocks originating in neurons serve to the formation of GCIs in MSA, (ii) show no sign of amyloid cross-seeding in either synucleinopathy, and (iii) point to the sequestration of mitochondria and of neuronal synaptic components in both LBs and GCIs.
Article
Similar neuronal imprint and no cross-seeded fibrils in α-synuclein aggregates from MSA and Parkinson’s disease
npj Parkinson’s disease – January 13, 2022
doi : 10.1038/s41531-021-00264-w.
Florent Laferrière 1,2,*, Stéphane Claverol 3, Erwan Bezard 1,2, Francesca De Giorgi 1,2,4,† and François Ichas 1,2,4,†,*
1 CNRS, Institut des Maladies Neurodégénératives, UMR 5293, Bordeaux, France.
2 Université de Bordeaux, Institut des Maladies Neurodégénératives, UMR 5293, Bordeaux, France.
3 Plateforme Proteome, Univ. Bordeaux, Bordeaux, France.
4 INSERM, Laboratoire de Neurosciences Expérimentales et Cliniques, U-1084, Université de Poitiers, Poitiers, France.
† Co-senior authorship.
* Corresponding authors.
Corresponding authors
 Florent Laferrière
Florent Laferrière
CR CNRS
Institut des Maladies Neurodégénératives – UMR 5293 – Université de Bordeaux / CNRS
Email:
Florent Laferrière vient d’être recruté en 2021 comme chargé de recherche CNRS au sein de l’équipe physiopathologie des protéinopathies d’Erwan Bézard, où il était en postdoctorat. Ses recherches consistent à caractériser la structure et les aspects pathogènes des agrégats d’alpha-synucléine impliqués dans diverses maladies neurodégénératives telles que la maladie de Parkinson ou l’atrophie multi-systématisée.
 François Ichas
François Ichas
Institut des Maladies Neurodégénératives – UMR 5293 – Université de Bordeaux / CNRS
Email:
Twitter : @FrancoisIchas
Mise à jour: 21/01/22
