Des hyperactifs sensibles à la douleur ?
Source : CNRS
Une étude sur un modèle murin de trouble du déficit de l’attention/hyperactivité (TDAH) montre que les symptômes d’hyperactivité, d’impulsivité et d’inattention s’accompagnent en outre d’une hypersensibilité aux stimulations douloureuses. Cette sensibilité est encore exacerbée dans des conditions de douleurs pathologiques. Ces travaux, publiés dans la revue PNAS, suggèrent que les circuits corticaux communs qui sous-tendent ces comorbidités neuropsychiatriques pourraient être la cible de traitements combinés.
Le trouble du déficit de l’attention/hyperactivité (TDAH) est un trouble neurodéveloppemental courant dont les symptômes comprennent l’inattention, l’hyperactivité et l’impulsivité. Les personnes atteintes de TDAH décrivent souvent des altérations sensorielles et notamment une sensibilité accrue à la douleur, ce qui suggère que l’hypersensibilité à la douleur et le TDAH peuvent être comorbides, l’un des deux troubles influençant l’autre et vice versa.
Les scientifiques ont analysé les mécanismes qui expliquent comment la transmission nociceptive et la perception douloureuse peuvent être modifiées par des désordres neurologiques et psychiatriques, notamment les comorbidités douloureuses des troubles neurodéveloppementaux du TDAH. Ils ont caractérisé et validé un modèle pharmacologique murin de TDAH obtenu par injection intracérébrale post-natale d’une toxine qui perturbe le développement du système dopaminergique. Ce modèle reproduit les symptômes du TDAH et répond au traitement de référence de cette maladie, le méthylphénidate.
Ils ont ensuite démontré sur ce même modèle une diminution des seuils de perception des stimuli mécaniques et thermiques. La sensibilisation qui accompagne une douleur inflammatoire persistante est en outre largement amplifiée chez les souris modèles de TDAH. Cette hypersensibilisation douloureuse se caractérise par une augmentation de l’activité des neurones la moelle épinière indiquant une altération de l’intégration sensorielle spinale chez les modèles de TDAH, probablement par la modification des contrôles descendants de la douleur. Afin d’identifier les circuits neuronaux impliqués, les scientifiques ont montré une hyperactivité du cortex antérieur cingulaire des souris modèles de TDAH, que ce soit en conditions basales ou après stimulation douloureuse périphérique. En utilisant des techniques d’optogénétique, ils mettent en évidence le rôle majeur de la voie « cortex cingulaire-cortex insulaire postérieur » dans l’altération de la réponse comportementale et de la décharge des neurones spinaux chez les souris modèles de TDAH. En inhibant cette voie, il est possible de réduire l’activité des neurones spinaux, et de diminuer les comportements douloureux.
L’ensemble de ces résultats indique que des mécanismes partagés sous-tendent la comorbidité entre le TDAH et la sensibilisation nociceptive. Cette interaction n’opère pas seulement sur la manière dont la douleur est perçue mais aussi sur la sensibilité aux stimuli externes relayés dans la moelle épinière. La sensibilisation nociceptive et l’hyperactivité se renforcent mutuellement, et les patients TDAH pourraient être plus vulnérables aux pathologies douloureuses. Ainsi, ces circuits communs pourraient être la cible de traitements combinés.
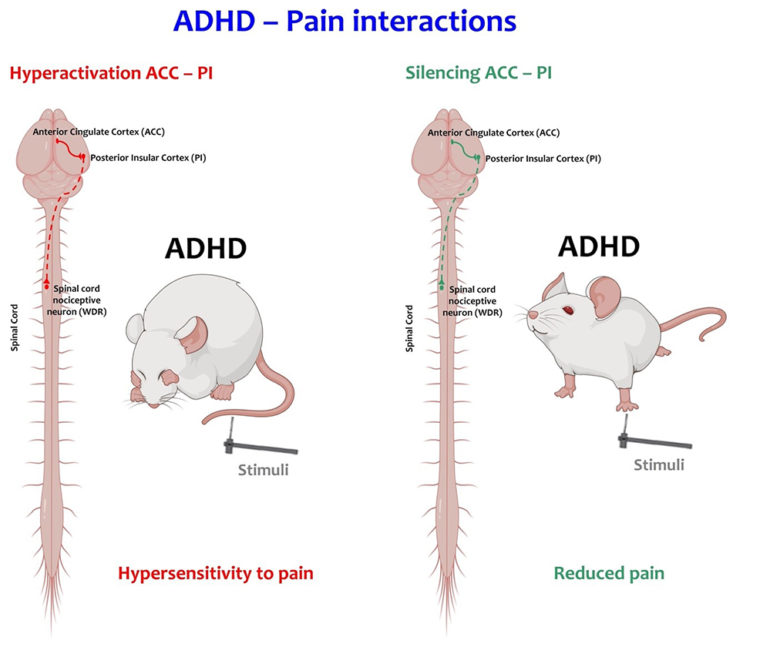
Figure : En condition de TDAH (ADHD, à gauche), l’hyperactivité de la voie cortex cingulaire (cc)-cortex insulaire postérieur, (PI) est hyperactive et augmente l’excitabilité des neurones de la moelle épinière (WDR) en réponse à des stimuli périphériques. Cette sensibilisation se traduit par une amplification des réflexes nociceptifs. Après inhibition optogénétique de cette voie ACC-PI chez des animaux TDAH (ADHD, à droite), l’excitabilité des neurones WDR revient à un niveau semblable à celui des animaux contrôles. Cette manipulation provoque une diminution des réflexes nociceptifs.
Référence
Pain hypersensitivity in a pharmacological mouse model of attention-deficit/hyperactivity disorder.
Otmane Bouchatta, Franck Aby, Sifeddine W, Rabia Bouali-Benazzouz, Louison Brochoire, Manouze H, Fossat P, Ba M’Hamed S, Bennis M, Landry M.
Proc Natl Acad Sci U S A. – Juillet 2022 . doi: 10.1073/pnas.2114094119.
Mise à jour: 14/10/22
