
Quand une fibrille synthétique s’auto-réplique dans le cerveau
L’atrophie multisystématisée (MSA) est une maladie neurodégénérative rare et incurable marquée par la présence d’inclusions intracellulaires faites de fibrilles d’alpha-synucléine. Dans un article publié dans Nature, des scientifiques montrent qu’un modèle particulier de fibrille d’alpha-synucléine créé artificiellement in vitro est capable de s’auto-répliquer et de proliférer dans le cerveau de souris, reproduisant les inclusions intracérébrales rencontrées dans la maladie humaine. Ces résultats ouvrent des perspectives inédites pour comprendre les mécanismes prion-like et concevoir de nouveaux inhibiteurs.
Une expérience pour comprendre la propagation de fibrilles pathogènes dans le cerveau
L’atrophie multisystématisée (MSA) est une maladie neurodégénérative rare et sévère, provoquée par l’accumulation massive et rapide de fibrilles d’α-synucléine dans le cerveau. Cette accumulation est observée dans d’autres synucléinopathies comme la maladie de Parkinson et la démence à corps de Lewy, mais avec un rythme de progression beaucoup plus lent. La question clé qui demeure : qu’est-ce qui confère à certaines fibrilles la capacité de se propager avec la rapidité d’agents infectieux, tandis que d’autres évoluent beaucoup plus lentement pendant de nombreuses années ?
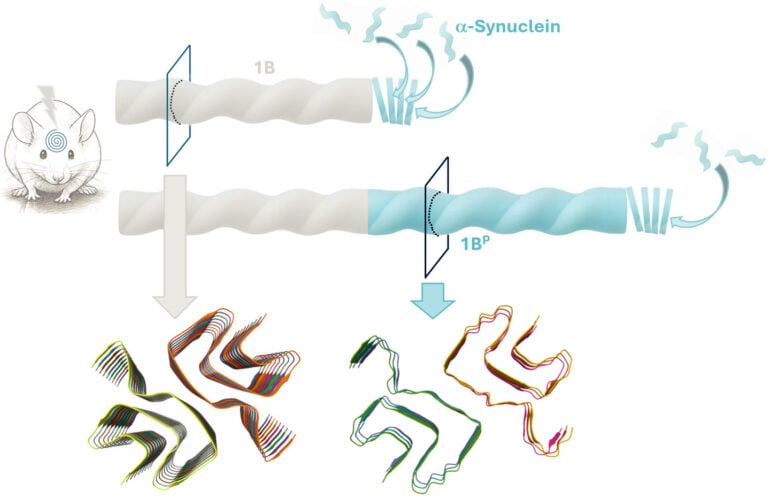
Pour y répondre, des scientifiques ont créé en laboratoire une fibrille spécifique d’α-synucléine, baptisée 1B, et l’ont injectée dans le cerveau de souris. Cette entité synthétique a induit l’apparition très rapide d’inclusions pathologiques similaires à celles observées dans la MSA. Les résultats de cette étude, publiés dans la revue Nature, apportent un éclairage inédit sur les mécanismes de propagation des synucléinopathies.
L’autoréplication observée à l’échelle atomique
À l’aide de la cryomicroscopie électronique, qui permet d’étudier la structure des protéines à l’échelle de l’atome, les scientifiques ont observé les fibrilles synthétiques avant inoculation (1B) et celles produites dans le cerveau sous l’effet de l’inoculation (1BP). Les deux structures se révèlent presque identiques. 1BP, conserve la même architecture de repliement, d’appariement et d’empilement qu’1B. Cette similarité démontre que la fibrille synthétique 1B a engendré sa propre copie dans l’organisme, un processus qui correspond à une véritable auto-réplication in vivo. L’existence d’un tel phénomène n’avait jusqu’à présent jamais été démontrée à l’échelle atomique chez l’animal, pas même pour les prions. Les homogénats dilués de cerveau de souris contenant ces fibrilles 1BP peuvent d’ailleurs à leur tour transmettre la pathologie à d’autres animaux par réinjection.
Vers une meilleure compréhension et de nouvelles stratégies thérapeutiques
Les scientifiques ont également identifié des régions structurales particulières qui semblent jouer un rôle central dans la capacité de ces fibrilles à se multiplier et à échapper aux systèmes cellulaires de dégradation.
« Ces travaux apportent la preuve expérimentale qu’un mécanisme réplicatif conformationnel – de type prion – est à l’œuvre dans les synucléinopathies », souligne François Ichas. « Ils ouvrent des perspectives pour comprendre comment certaines formes d’assemblage de l’alpha-synucléine deviennent pathogènes et pour concevoir des stratégies visant à interrompre ce processus. »
Ce travail fournit un modèle expérimental robuste des mécanismes prion-like qui sous-tendent la MSA et d’autres synucléinopathies, telles que la maladie de Parkinson ou la démence à corps de Lewy. Il met également en lumière les bases structurales supramoléculaires qui différencient ces pathologies. À plus long terme, l’identification des interfaces critiques exposées par les fibrilles 1B pourrait guider la conception d’inhibiteurs capables d’empêcher leur propagation. Cette découverte invite également à repenser les frontières entre entités biologiques et agents pathogènes d’origine artificielle.
Référence
Synthetic α-synuclein fibrils replicate in mice causing MSA-like pathology
Domenic Burger, Marianna Kashyrina, Lukas van den Heuvel, Hortense de La Seiglière, Amanda J. Lewis, Francesco De Nuccio, Inayathulla Mohammed, Jérémy Verchère, Cécile Feuillie, Mélanie Berbon, Marie-Laure Arotcarena, Aude Retailleau, Erwan Bezard, Marie-Hélène Canron, Wassilios G. Meissner, Antoine Loquet, Luc Bousset, Christel Poujol, K. Peter, R. Nilsson, Florent Laferrière, Thierry Baron, Dario Domenico Lofrumento, Francesca De Giorgi, Henning Stahlberg, François Ichas
https://www.nature.com/articles/s41586-025-09698-1
Contacts
Dr. François Ichas
Institut des Maladies Neurodégénératives CNRS Université de Bordeaux, France
Laboratoire d’Anatomie Humaine, DiSTeBA, Université du Salento, Lecce, Italie.
Prof. Henning Stahlberg,
Laboratoire de Microscopie Electronique Appliquée à la Biologie, Ecole Polytechnique Fédérale de Lausanne, Université de Lausanne, Lausanne, Suisse.
Mise à jour: 18/11/25
